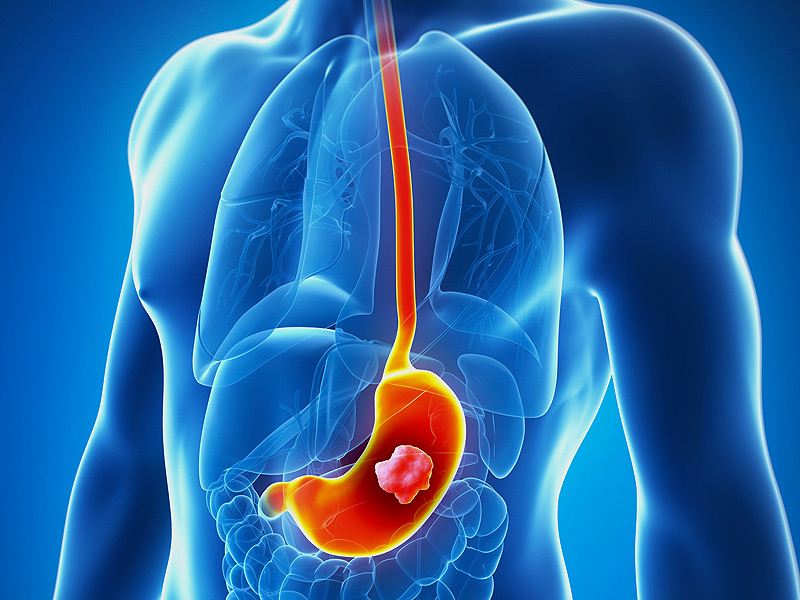
СТАНДАРТ ЗА ЛЕЧЕНИЕ НА СТОМАШНИЯ КАРЦИНОМ
 Епидемиологичните характеристики, липсата на ефективни скринингови програми, комплексната етиология, неспецифичната клинична картина, късното диагностициране, ниската преживяемост дори след потенциално радикално хирургично лечение, незадоволителния отговор на лъче и химиотерапия, трудната социална адаптация на болните претърпели тежките блокови резекции прилагани при стомашния рак и незадоволителното качеството на живота им определят стомашния карцином като значим медико-социален проблем.
Епидемиологичните характеристики, липсата на ефективни скринингови програми, комплексната етиология, неспецифичната клинична картина, късното диагностициране, ниската преживяемост дори след потенциално радикално хирургично лечение, незадоволителния отговор на лъче и химиотерапия, трудната социална адаптация на болните претърпели тежките блокови резекции прилагани при стомашния рак и незадоволителното качеството на живота им определят стомашния карцином като значим медико-социален проблем.
Епидемиология, заболеваемост, пол, греографско разпределение, преживяемост
В последните две десетилетия рака на стомаха заема четвърто място по честотапри онкологичните заболявания вчовешката популация, второ място (след рака на белия дроб/бронхите) като причина за смърт всред онкологично болните мъже и пето място (след рака на гърдата, cervix uteri, бял дроб/бронхи,дебело черво/ректум) като причина за смърт всред онкологично болните жени. Най-засегната е възрастта над 55 г. като връх на заболеваемостта се регистрира между 65-74 г. Честотата и смъртността от заболяването са два пъти по-високи при мъжете спрямо жените.
Заболеваемотта от рак на стомаха показва широки географски различия, варирайки от 0.6/100 000 мъже в Камерун до 77.9/100 000 мъже в Япония и от 0.6/100 000 жени в Габон до 33.3/100 000 жени в Япония. Като цяло честотата на заболяването е висока за Азия (Япония, Корея, Китай, Русия) и някои части на Южна Америка (Коста Рика, Перу, Салвадор, Колумбия).По-ниска е заболеваемостта в района на Северна Америка и повечето държави в Африка. Епидемиологичните данни за България от последните 20 г. показват задържане нивата на заболеваемостта между 19.9 и 24.4/100 000, коетони поставя сред страните със сравнително високо ниво на заболеваемост (между 13.1-23.5/100 000). През 2005 г. новозаболелите от стомашен рак са 1795 (23.2/100 000), което представлява 22% от рака на храносмилателния тракт и 5.6% от общата онкологична заболеваемост. От тях в І стадий са 3.4%, във ІІ стадий – 10.8%, в ІІІ стадий – 22.8%, в ІV стадий -38.2% (24.8% от случаите не са стадирани!). През същата година в страната починалите от рак на стомаха са 1599, съставляващи 20.7/100 000 фактическа смъртност (9 % в структурата на общата онкологична смъртност – 9.4% за мъжете и 8.5% за жените).
В глобален аспект епидемиологичните данни за последните 50 г. очертават следните основни тенденции – постепенно снижаване нивото на заболеваемостта, промяна в честотата анатомичната локализация (покачване на локализациите в проксималните отдели на стомаха), лоша прогноза и ниската преживяемост дори след радикално хирургично лечение в потенциално лечим стадий и мултимодален подход.
Пет годишната преживяемост при пациентите оперирани за рак на стомаха показва значителни различия според стадия на заболяването и като цяло е ниска. За напредналите стадии (ІІІВ и ІV) е между 5-17%, за потенциално лечимите стадии (ІВ-ІІ-ІІІА) е между 18-35%, за ранния стомашен рак е между 78-95%като японските автори традиционно съобщават по-висока прежияемост при всички стадии.
Етиология, патогенеза и рискови фактори
Причината за развитието на стомашния карцином не е известна. Приема се, че възможността за поява на болестта е по-реална при едновременното наличие и комбиниране на патологичния потенциал на рисковите фактори на заболяването. В зависимост от значимостта им за развитието на стомашния рак рисковите фактори се разделят на две основни групи – фактори повишаващи риска и фактори намаляващи риска. Всяка от тези групи се разделя на три подгрупи – облигатни, вероятни и предполагаеми. Същевременно рисковите фактори са с различна стойност според локализация на стомашния рак – дистална или проксимална локализация.
Фактори повишаващи риска при дистална локализация на стомашния рак са:
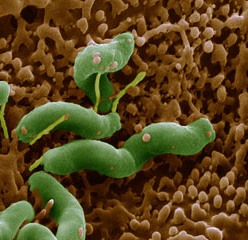
• Облигатни: мъжки пол, напреднала възраст, атрофичен гастрит, интестинална метаплазия, дисплазия, стомашен аденом, резекция на стомаха с давност>20 г., пернициозна анемия, инфекция с Helicobacter pylori, HNPCCсиндром (хередитарен неполипоиден колоректален рак);
• Вероятни: фамилна анамнеза, фамилна аденоматозна полипоза, кръвна група „А”, злоупотреба със сол, ексцесивно тютюнопушене;
• Предполагаеми: нисък социално-икономически статус, професионални вредности, болест на Menetrie, хамартом на стомаха, наличие на Epstein-Barrвирус в стомаха, храни богати на нитрати. Фактори понижаващи риска при дистална локализация на стомашния рак са:
• Облигатни: консумация на неконсервирани храни, пресни плодове и зеленчуци, актино лечение на язвената болест и ерадикация на Helicobacter pylori;
• Вероятни: употреба на vit „С”;
• Предполагаеми: употреба на каротиноиди, чесън, зелен чай, аспирин и нестероидни противовъзпалителни средства, храни съдържащи селен.
Фактори повишаващи риска при проксимална локализация на стомашния рак:
• Облигатни: баретов хранопровод, интестинална метаплазия, наднормено тегло, тютюнопушене, професионални вредности, нисък социално икономически статус.
Фактори понижаващи риска при проксимална локализация на стомашния рак
• Облигатни: CagA-positive H. pylori.
Патогенезата
Стомашния карцином се свързва с определена етапност и последователност на патологичните промени в стомашната лигавица, на фона на хроничен възпалителен процес: хроничен суперфициален гастрит→атрофичен гастрит → интестинална метаплазия → дисплазия → карцином. Благоприятвуващи фактори са хипохлорхидрията, бактериалната колонизация, активната клетъчна пролиферация, увеличаване броя на анеуплоидните клетки и хипергастринемията, която стимулира патологичното разрастване на мукозата. Дисталната локализация на рака се асоциира схронично възпаление свързано с контаминацията на H.pylori, докато проксималната локализация се свързва с гастроезофагеалния рефлукс и патологичното наднормено тегло. Диетичните рискови фактори причиняват гастрит и атрофия на стомашната лигавица. Прехода на учстъци от лигавицата с атрофичен гастрит в тънкочревна метаплазия се влияе положително от нитрозосъединения и наличието на анаеробни бактерии, при метаболизма на които нитратите се превръщат в нитрити. Впоследствие при взаимодействието на нитритите с други азот-съдържащи съединения (приети чрез храни и лекарства) вероятно се създават условия за отключване на мутагенеза. Счита се, че връзката между инфекцията с H.pylori и развитието на стомашен рак е налице, особено при дълготраен съпъстващ активен възпалителен процес. Имунният отговор към инфекцията с H. Рylori отключва действието на комплекс от инфламаторни медиатори като хемокини (интерлевкин-8), преинфламаторни цитокини (интерлевкин-1, интерлевкин-6, tumornecrosisfactor) и имуносупресивни пептиди (интерлевкин-10). Хроничната инфекция води до промяна на клетъчния цикъл, повишаване синтеза на ДНК в епителните клетки, увеличаване на апоптозата и продукцията на оксиданти. Това заедно с изчерпването на антиоксидантните възможности на организма повишава вероятността от ДНК мутагенеза и отключване на веригата – метаплазия→дисплазия→аденокарцином.
Генетични нарушения
Стомашната канцерогенеза представлява прогресиращ многоетапен процес, участие в който имат активирани онкогени, мутации в туморсупресорни гени, загуба на хетерозоготността на хромозомите, съдържащи туморсупресорни гени, грешки в ДНК репликацията, активиране на тъканни разтежни фактори и др. Открити са множество генни аномалии при рака на стомаха, но отключващият фактор все още не е доказан
Профилактика
Скриниговите програми са с доказана неефективност при стомашния карцином. Профилактичните мероприятия са насочени към ограничаване на факторите повишаващи риска от развитие на стомашен рак и клинично обхващане на застрашени групи от населението, формирани на базата на наличието на рисковите фактори. Тези групи са: лица, преживели стомашна резекция по повод на язвена болест преди повече от 10 г.; лица над 50 г. с анамнеза за стомашни оплаквания в продължение на няколко седмици; лица с полипоза, хроничен атрофичен ахиличен гастрит с/без интестинална метаплазия и атрофичен гастрит тип А; лица с фамилна анамнеза за рак на стомаха, на възраст над 50 г. и наличие на стомашни оплаквания; лица над 50 г. с данни за трайно намаляване на апетита и необяснима редукция на тегло.
Клинична картина
Клиничната картина на стомашния рак е неспецифична и физикалната находка дълго време е негативна, което е основната причина за късното диагностициране на заболяването.
Ранни симптоми: немотивиран астено-адинамичен синдром, намаление до пълна загуба на апетит, упорит стомашен дискомфорт и др.
Късни (манифестни) симтоми: епигастрална болка, тежест след нахранване, повръщане (вкл. хематемеза), дисфагия, редукция на телесна маса; регургитации с дъх на млечни продукти, анемия и др. Паранеопластичните синдроми като мигриращият тромбофлебит на Trousseau, acanthosis nigricans и периферна невропатия са редки.
Диагностика. Стадираща диагностика
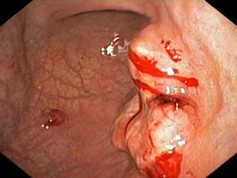
Основен и задължителен метод за поставяне на диагнозата при рак на стомаха е горната гастроитестинална ендоскопия с множествена биопсия и хистологично изследване. Тя осигурява важни данни като – локализация на лезията, хистологичен вид, степен на диференциация, типпо Borrmann и Lauren. При случаите със сублигавично разтящ карцином (най-често тип linitis plastica), при които и повторната ендоскопия с биопсия е отрицателна може да се използва полипозиционно рентгеново изследване с двоен контраст и с динамично и фармакодинамично скопично проследяване на стомашния пасаж. Съвременни варианти на ендоскопското изследване с много висока диагностична стойност са увеличителната ендоскопияс висока разделителна способност (magnification and high resolution endoscopy), която позволява разграничаване на обекти с размери от 10 до 71µm и хромоендоскопията (chromoendoscopy), при която на базата на различната абсорбционна способност на различните клетъчни видове към багрила, се описват няколко типа строеж на стомашната мукоза, всеки от които корелира с наличието на интестинална метаплазия и дисплазия.
Стадиращата диагностика цели подобряване на оценката в предлечебния стадий на болестта (определяне категориите T,N и M).Допринася за сформирането на пациентите в групи подходящи за съответния вид лечение и намалява броя на некуративните лапаротомии. Тя представлява комплекс от изследвания включващ физикален преглед, хематологични, биохимични изследвания, туморни биомаркери(СА 72-4, СЕА), рентгенография на бял дроб (като част от рутинния предоперативен скрининг) и допълнителни ендоскопски, образни и инвазивни методи, комбинацията от които повишава вероятността за точно стадиране.
• Ендоскопска ултрасонография – понастоящем е стандарт при подхода за определяне на Т – стадия (високо ниво на чувствителност и специфичност) и има високо ниво на достоверност при определяне на N – стадия (предимно за перитуморните лимфни възли);
• Компютърна томография и ядреномагнитен резонанс – отличават се с високо ниво на чувствителност при уточняване на М-категорията. Съвременните мултидетекторни компютърни томографи и фазов ядреномагнитен резонанс, осигуряващи по-тънки срезове за по-кратко време имат висока информативна стойност както за Т, така и за N – стадия;
•Ултразвуково изследване – достъпен и икономически ефективен метод с отношение най-вече към определяне на М-стадия;
• Диагностична лапароскопия, лапароскопска ехография и перитонеален лаваж – общата им диагностична стойност достига точност от 92% включително за T,N и М стадиите. На практика метода единствен дава възможност да се установи и потвърди хистологично наличието на перитонеални метастази. Лапароскопията все още не се приема за рутинно приложение, защото от една страна е по-полезна при авансиралите случаи, когато може да предотврати една нелечебна лапаротомия и не е толкова необходима при ранните стадии на болестта.В контекста на мултимодалния подход към стомашния карцином пациентите суспектни за Т4, N3 или М1 са показани за извършването на диагностична лапароскопия. Целесъобразно е методът да се прилага след извършването на ендоскопска ехография, при подозиране на Т3-Т4 тумор, когато вероятността от наличието на перитонеални метастази е голяма. Лапароскопската ехография уточнява допълнително Т – стадия, чрез откриването на чернодробни метастази < 1 см. и на нерезектабилни лимфни метастази. Положителните резултати при изследването на перитонеална течност (перитонеален лаваж) при диагностичната лапароскопия определят напредналия стадий на заболяването. Засега изследването (включително и изследването на перитонеална течност при конвеционална операция) не се асоциира с категориите на TNMсистемата.
Други диагностични методи:
• FDG-PET (позитронна емисионна томографияс използване на радиофармацевтик – флуородезоксиглюкоза) е метод с 98-100% чувствителност и 89% специфичност. РЕТочертава тъканите с повишен глюкозен метаболизъм (каквито са неопластичните), но не осигурява добро анатомично представяне, поради което е подходящо да се комбинира с компютърна аксиална томография. Основно дава информация за категорията М.
• генетични прогностични маркери и имуноцитологично изследване на абдоминален аспират – обикновено са част от научно-изследователски програми в специализирани центрове и не се прилагат рутинно в клиничната практика.
Патоанатомия, класификации, стадиране, стадиращи системи
Аденокарцинома съставлява 90-95% от злокачествените стомашни тумори, 2-3% заема стомашния лимфом и останалите проценти се допълват от мезенхимни и невроендокринни малигноми. Аденокарцинома на стомаха се характеризира с висок локален и метастатичен биологичен потенциал и се разпространява по четири начина – лимфогенно, чрез прорастване в съседните на стомаха тъкани и органи, чрез имплантационни метастази и хематогенно.
Патологоанатомичното класифициране и стадирането на стомашния карцином са тясно свързани в значението си при определяне на терапевтичния подход и прогнозата при заболяването. Пълноценно стадиране е възможно само след хирургична интервенция. Eлементите в съвременното стадиране на стомашния рак са описателните категории и дефинициите. Описателните категории включват характеризирането на символите T, N и М (по AJCC/UICC); хистологично класифициране – по СЗО, Borrman, Lauren;G- хистопатологично градиране (Gx, G1, G2, G3, G4); R – наличието или липсата на остатъчен тумор след осъществавяне на оперативната интервенция (Rx, R0, R1, R2); L – наличието на лимфна инвазия (Lx, L0, L1); V – оценка на венозната инвазия (Vx, V0, V1, V2); С – диагностични методи ползвани при стадирането на тумора (С1, С2, С3, С4, С5); когато класифицирането на случая става по време или след провеждането на някакво лечение (напр. неоадювантна лъче и химиотерапия) се използва префикс “у”; наличието на множествени първични тумори се отбелязва със суфикса “m” – например pT(m)NM; характеризирането на рецидивиращ тумор, последващ „светъл период” след хирургично лечение се отбелязва с префикса „r”;когато случая се класифицира чрез аутопсия се ползва префикса „а”. Общоприети са две основни системи за стадиране на стомашния рак. Едната е TNM класификацията – международно утвърдена през 1986 г. от American Joint Committee onCancer (AJCC) и International Union Against Cancer(UICC).Другата е Японската класификация утвърдена от Японското общество за проучване на стомашния карцином (JRSGC-JapaneseResearchSocietyforGastricCancer) през 1963 г. Държавите от Европа и Америка ползват задължително TNM стадиращата система. В последнитегодини в националните хирургически стандарти на тези държави, при дефиниране на обема на оперативните интервенци по повод стомашен карцином се използва официално един от критериите на Японската система – категорията D. Той отразява обема на лимфната дисекция като неразделна част от адекватната хирургична интервенция в потенциално лечимите стадии на заболяването.Възприемането му в настоящия стандарт за лечение на стомашния рак е предпоставка за синхронизиране на дефинициите за обем и адекватност на оперативното лечение в съзвучие с европейските и световни тенденции.
За целите на стадирането е подходящо да се изплзват хистоморфологични, макроскопски и TNM критерии. Патологоанатомичното класифициране има два аспекта – макроскопска и хистоморфологична оценка. За макроскопска оценка най-разпространена днес е класификацията за напредналия стомашен карцином на R.Borrmann от 1926 год.
Макроскопска класификация на стомашните карциноми на R.Borrmann:
•тип I- полипоиден тумор,
•тип II- улкус-карцином без инфилтрация на съседна тъкан,
•тип III- инфилтративен улкус-карцином;
•тип IV- представлява т.н. дифузен рак, с образуване на плоски плакоподобни участъци, разпростиращи се в мукозта и субмукозата, с изразена ригидност, задебеляване и инфилтриране на цялата дебелина на стомашната стена. Някои автори добавят и V тип – некласифицируеми карциноми.
Хистологична класификация на стомашните карциноми на СЗО:
Adenocarcinoma :
• Papillary adenocarcinoma
• Tubular adenocarcinoma
• Mucinous adenocarcinoma
• Signet-ring cell carcinoma
Adenosquamous carcinoma
Squamous cell carcinoma
Small-cell carcinoma
Undifferentiated carcinoma
Хистологична класификация на стомашните тумори на Lauren:
• тип І – дифузен
• тип ІІ – интестинален
По степен на зрелост на клетките аденокарциномът бива: с висока (G1), средна (G2) и слаба (G3)степен на диференциране.
Класификацията на Lauren (1965г.) показва висока прогностична достоверност. Има доказано практическо значение в оперативно-тактически аспект при определяне границите на стомашната резекция. Туморите от интестиналния тип са добре отграничени и макроскопски границите тумор/здрава тъкан са достоверни. Хистологичното разпространение на карцинома извън тях обикновено е няколко милиметра. По-типична за този тип е локализацията в дисталните стомашни отдели, при пациенти в напреднала възраст, с дълга предракова фаза (най-често атрофичен гастрит) на болестта и асоциация с H. pylori. При туморите от дифузния тип хистологично установимото разпространение по-често е няколко сантиметра извън макроскопски очертаните граници тумор/здрава тъкан. Поради това макроскопската оценка в сравнение с интестиналния тип е по-несигурна. Туморите от дифузния тип имат по-лоша прогноза и по-често дават лимфни и перитонеални метастази. Могат да се развият във всяка част на стомаха, но са по-чести в зоната на кардията,при по-млади пациенти, без клинични данни за предракова фаза на заболяванетои предшествуваща интестинална метаплазия.
TNM (AJCC-UICC-2002) – класификация
Систематизирането на уврежданията и определянето на стадия на заболяванетосе извършва според степента на проникване на тумора в стомашната стена (Т), метастатичното ангажиране на определен брой лимфни възли (N) – без отчитане на анатомичната им локализация и наличието или отсъствието на отдалечени метастази (М)
Първичен тумор (T)
Tх Първичния тумор не може да се прецени
T0 Няма данни за първичен тумор
Tis Ca. in situ – интраепителиален тумор без данни за инвазия на lamina propria
T1 Тумор инфилтрирал lamina propria или submucosa
T2 Тумор инфилтрирал muscularis propria или subserosa *
T2 a: Тумор инфитрирал muscularis propria
T2 b: Тумор инфилтрирал subserosa
T3 Тумор инфитрирал серозата (висцералния перитонеум) без данни за инфитрация на съседни структури
T4 Tумор инфилтрирал съседни структури
Регионални лимфни възли (N)
Nх Регионалните л.в. не могат да бъдат оценени
N0 Няма метастази в регионалните л.в.
N1 Има метастази в 1- 6 регионални л.в.
N2 Има метастзи в 7 – 15 регионални л.в,
N3 Има метастази в повече от 15 регионални л.в.
Далечни метастази (M)
Mх Наличието на далечни метастази не е оценено
M0 Няма наличие на далечни метастази
M1 Налични са далечни метастази
Стадии:
Садий 0: Tis N0 M0
Стадий IА: T1 N0 M0
Стадий IВ: T1 N1 M0; T2 N0 M0
Стадий II: T1 N2 M0; T2 N1 M0; T3 N0 M0
Стадий IIIА: T2 N2 M0; T3 N1 M0; T4 N0 M0
Стадий IIIВ: T3 N2 M0
Стадий IV: T 1-3 N2 M0; T4 N1-2 M1
Лечение на стомашния карцином (в стадий ІВ, ІІ, ІІІ)
Основен метод за лечение на карцинома на стомаха е хирургичният.Това е единствения метод, който дава шанс на болния за дълготрайна преживяемост. Химиотерапията се препоръчва като адювант към хирургичното лечение и при неоперабилни тумори. Оперативната намеса се планира и извършва съобразно стадия на болестта и локализацията на туморния процес.
Оперативната инервенция при стомашния карцином се дефиниракато блокова резекция, включваща туморсъдържащата част на стомаха (или целия стомах), omentummajus, omentumminus, предния лист на mesocolontransversum, цялото или част от перитонеалното покритие на панкреаса, адекватен обем лимфна дисекция и последваща гастроинтестинална реконструкция за възстановяване на чревния пасаж. Разширяването на обема на блоковата резекция с включването на съседни на стомаха органи (комбинирана резакция) е по определени индикации – локална инфилтрация или метастази. Стадирането на стомашния рак по TNM – системата е задължително. При планирането и описанието на обема на оперативните интервенции се препоръчва смесен подход, с използването на категориите от TNM класификацията и категорията „D” – обем на лимфната дисекция по Японската класификация. Подобен подход е залегнал в стандартите на повечето европейски държави и САЩ. Главна особеностна Японската класификация е анатомичното детайлизиране на стомашната лимфна система, което подобрява подхода към локорегионалния контрол при лимфаденектомията.
Общи препоръки при хирургичното лечение на стомашния карцином:
• Изграждане на оперативната стратегия според стадия на заболяването, включително и от предоперативните ендоскопски и хистологични данни за макроскопския тип на карцинома по Borrmann и хистологичния вариант по Lauren;
• Кандидати за радикално оперативно лечение са пациентите в 0,І,ІІ и ІІІA-В стадий на болестта;
• Целта на оперативната интервенция е извършване на R0 резекция (без остатъчен тумор);
• При радикалните операции отстоянието на резекционната линия проксимално от горната видима граница тумор/здрава тъкан да е най-малко 5-7 см., като това се съобразява с хистологичния грейдинг и интраоперативната оценка за всеки отделен случай, а отстоянието на резекционната линия от долната граница на тумора да е минимум 3 см. под пилора;
• Интраоперативно трябва да се съобразят следните фактори:
– пенетрация на карцинома в стомашната стена (обхващане на серозата) – ангжираност на лифните колектори
– тип по Borrmann и Lauren
– чистота на резекционните линии
– наличието на извънстомашни метастази.
• Туморите ІV-ти и V-ти вариант по Borrmann и дуфузен тип по Lauren са с по-лоша прогноза и изискват по-голям обем опративна намеса;
• Рутинното извършване на спленектомияс/без резекция на опашката на панкреаса без строги индикации не се препоръчва тъй като не повишава преживяемостта, а повишава следоперативните усложнения.
Обем на стомашната резекция
1.Тотална гастректомия с D1/D2 лимфна дисекция при:
• локализации в тялото и фундуса на стомаха;
• локализации в дисталната трета, ако са нискодиференцирани, ІV-V-ти тип по Borrmann, дифузен вариант по Laurenи/или морфологичен вариант “пръстен с камък”;
2. Проксимална субтотална гастректомия с D1/D2лимфна дисекция (като алтернатива на тоталната гастректомия при проксималната туморна локализация) се прилага, като индикациите за тази процедура се стесняват до наличието на субкардиално разположен, добре отграничен от околните тъкани и малък по размери тумор.
3. Дистална субтотална гастректомия с D1/D2 лимфна дисекция:
• при рак на дисталната и средната трета на стомаха;
• при предоперативно доказан интестинален тип аденокарцином;
• отстранява се задължително минимум 75% от обема на стомаха;
По отношение обема на резекцията на стомаха при карцином е прието становището, че при педантично спазени онкологични изисквания субтоталната дистална стомашна резекция е предпочитан вид операция поради по-добрите функционални резултати.Във всички останали случаи метод на избор е тоталната гастректомия.
Обем на лимфната дисекция
Лимфната дисекция е основен етап от хирургичната интервенция при стомашния карцином. Количеството отстранени лимфни възли е един от важните прогностични показатели при заболяването. Лимфаденектомията се извършва по хода на регионалните за стомаха лимфни възли и лимфоотток, следващ стомашните кръвоносни съдове: покрай голямата и малката стомашни кривини, парапилорично, трункус целиакус, лявата стомашна артерия, лиеналната артерия, общата чернодробна артерия, ляво и дясно паракардиално. За коректно извършена се приема лимфна дисекция, при която са отстранени поне 15 бр. лимфни възела (минималния брой необходим за определяне на N категорията по TNM) като за ІІ и ІІІ стадий е нужно да са отстранени повече от 25 бр. лимфни възела.С цел подобряване на подхода към локорегионалния контрол при лимфаденектомията, при извършване и отразяване обема на лимфната дисекция се препоръчва използванетона категорията “D” и разпределението на лимфните възли по региони според Японската класификация. Модифицирането на стандартните обеми D1 и D2 лимфни дисекции за всяка от трите основни части (горна, средна и долна трета) на стомаха се извършва при строга оценка на локалния статус за всеки отделен случай (определящи се Ти N категориите) и най-вече според разположение на тумора в близост до съответния лимфен регион и степента на инфилтрация на стомашната стена.
Препоръчителни обеми на оперативната интервенция при рак на стомаха според стадия на болестта и локализацията на туморния процес:
1. При локализация в дисталната трета на стомаха: при ІВ и ІІ стадий → дистална субтотална резекция или гастректомия; при ІІІАи ІІІВ → гастректомия;
2. При локализация в средната трета на стомаха: при стадии ІВ, ІІ, ІІІА, ІІІВ → гастректомия; →дистална субтотална резекция при сигурни данни за N0;
3. При локализация в проксималната трета на стомаха: при стадии ІВ, ІІ, ІІІА, ІІІВ →гастректомия; →проксимална субтотална резекция – по строги индикации в І стадий;
При пациенти в ІV-ти стадий на заболяването, които са в добро общо състояние се обсъжда извършването на стомашна резекция включително гастректомия с цел циторедукция, дезинтоксикация и осигуряване на хранителния пасаж, а при подходяща селекция на болни с М1 се обсъжда извършването на комбинирани резекции. В останалите случаи се препоръчват палиативни оперативни намеси целящи осигуряване на хранителния пасаж или преодоляване на спешни състояния. При случаите с големи по обем тумори, дифузен тип по Lauren, хистологично нискодиференцирани и ІV вариант по Borrmannсе обсъжда разширяване обема на лимфната дисекция над D2 според локализацията на процеса.При локализации по голямата кривина и технически трудности при лимфната дисекция на 10 и 11 региони (около проксималната и дисталната част на a. lienalis) се извършва спленектомия без/с резекция на панкреатичната опашка с цел подобряване на локалния контрол върху лимфаденектомията.
Реконструкция след тотална гастректомия
Основната цел при възстановяването на хранителния пасаж след гастректомия е осигуряване на по-добро качество на живот, главна предоставка са което е адекватното хранене. Независимо от вида реконструкция, отдалечените функционални резултати (>2г.) са сходни.
Възможния набор от реконструктивни техники е:
• Roux-n-Y или Brаun
• Със запазване на дуоденалния пасаж (йеюнална интерпозиция)
• С конструиране на резервоар – проксимален, дистален, двоен
• Със запазване на дуоденалния пасаж и резервоар
Резултатите след хирургичното лечение на стомашния рак са пряко свързани със стадия на заболяването. Най – важни прогностични критерии са степента на инфилтрация на серозата от туморния процес и обема на лимфната дисекция независимо от броя метастатични лимфни възли в оперативния препарат.
Карцином на гастроезофагеалната връзка
Рака на гастроезофагеалната свръзка е особен вид карцином, който се различава епидемиологично, биологично и прогностично от рака на останалите части на стомаха и рака на хранопровода.
Различават се 3 типа такива карциноми:
І тип – аденокарциноми произхождащ от дисталния хранопровод, инфилтриращи гастроезофагеалната връзка отгоре. Стандартната операция при този тип карциноми е тораколапаротомия с резекция на дисталната част на хранопровода или езофагектомия, проксимална стомашна резекция и спленектомия, медиастинална лимфаденектомия, перигастрална лимфна дисекция и гастроезофагеална анастомоза.
ІІ тип – аденокарцином произхождащ от епитела на самата кардия. При І и ІІ стадии на този тип тумори се препоръчва лява торакофренолапаротомия, тотална гастректомия съчетана с D2 лимфна дисекция и дистална резекция на хранопровода с последваща реконструкция по типа Roux-n-Y, тънкочревна или дебелочревна интерпозиция. При по-напредналите стадии, както и при дифузен тип по Lauren се препоръчва абдоминодясноторакален достъп, тотална гастректомия и езофагектомия с шийна езофагоколостомия.
ІІІ тип – аденокарцином произхождащ субкардиално, който инфилтрира гастроезафагеалната свръзка и дисталния хранопровод отдолу. Тук се препоръчва тотална гастректомия с D2 лимфаденектомия и резекция на дисталния хранопровод чрез лява торакофренолапаротомия и възстановяване на пасажа чрез Rou-n-Y, тънкочревна или по-рядко дебелочревна интерпозиция.
Ранен стомашен карцином (Стадий 0 и ІА)
Ранния стомашен аденокарцином на стомаха се дефинира като ограничен в рамките на мукозата и/или субмукозата малигнен процес, независимо от наличието на метастатични лимфни възли. Резултатите от хирургичното лечение на ранния стамашен рак са много добри – около 96-98% 5-годишна преживяемост и 95% 10-годишна преживяемост.
Епидемиология
В глобален аспект над 70% от съобщаваните случаи на ранен стомашен рак са от азиатски автори (Япония, Корея, Китай). Това се асоциира със скриниговите ендоскопски програми при асимптоматични високорискови групи пациенти и прилагането на методите на увеличителна и хромоендоскопия в тези страни. Ранния стомашен рак е по-чест е при жените спрямо мъжете, в съотношение 3-5:1.
Класификации
Използват се хистоморфологичната класификация на СЗО, хистологичната класификация на Lauren и макроскопската класификация на Японското общество на ендоскопистите.
Лимфно метастазиране
При ранния стомашен карцином има лимфно метастазиране. Честотата му зависи от дълбочината на туморната инвазия в стомашната стена. Когато тумора е локализиран в мукозата (Тis), честотата наметастазите в лимфните възли е около 3-5 % и е предимно в регионалните лимфни възли. Когато процеса инвазира субмукозния слой (Т1), честотата на лимфните метастази се покачва на 15-20%, като се откриват метастази и в извънрегионални лимфни възли.
Диагноза
Горна интестинална ендоскопия с множествени биопсии (5-10 на см2) на суспектните лезии, хромоендоскапия, увеличителна ендоскопия, ендоскопска ултрасонография.
Лечение
Основен метод за лечение на ранния стомашен рак е хирургичният.
Препоръчват се два варианта на оперативен обем при дисталните и корпусните локализации:
Вариант А. Резекция на стомаха в обем 75% (или по-малко) и D1 лимфаденектомия + дисекция на 7 регион лимфни възли (по хода a.gastrica.sin.) – при добре диференцирани тумори, локализирани в мукозата/субмукозата и с диаметър<1.5см,
Вариант В. Резекция на стомаха в обем 75% (или по-малко) и D1 лимфаденектомия + дисекция на лимфни региони 7 (по хода a.gastrica.sin.), 8 (по хода на a.hepatica communis) и 9(около tr.celiacus) – при всички случаи, когато тумора не отговаря на изискванията за резекция Вариант А.
При проксималните локализации се препоръчва проксимална резеция в онкологично чисти граници с модифицирана лимфна дисекция в обем D1 + региони 10 (л.в. в хилуса на слезката) и 11 (л.в. около проксималната и дисталната част на a.lienalis), при стремеж към запазване на слезката.
При строго селекционирани пациенти и при педантично спазване на онкологичните оперативни приципи могат да се извършват ограничени резекции при ранен стомашен карцином – пилорозапазващи стомашни резекции, лапароскопски резекции, комбинирани ендоскопско-лапароскопски клиновидни ексцизии на цялата дебелина на стомашната стена.
В условията на специализирани центрове се извършва ендоскопска мукозна резекция (ЕМР) при стриктно изпълнение на следните критерии: ограничен в мукозата тумор, хистологично добре диференциран и по-малък от 2 см.
При всички други случаи метод на избор е оперативната интервенция.
Химиотерапия
Адювантната и неоадювантната химиотерапия не са стандартно лечение в рутинната практика при стомашния карцином.
Основания за провеждане на адювантна химиотерапия са:
• заболяване в стадий ІВ, ІІ, ІІІА-В, ІV;
• наличие на микрометастази в лимфните възли;
• наличие на микроскопска перитонеална дисеминация;
• метастазирало заболяване;
• непълноценна хирургия.